Tekanan osmotik merupakan salah satu konsep yang penting dalam bidang biologi yang berhubungan dengan pergerakan zat terlarut melalui membran semipermeabel. Dalam artikel ini, kami akan membahas definisi osmotik, cara menghitungnya menggunakan rumus yang tepat, dan menyajikan beberapa contoh soal untuk memperjelas pemahaman.
Selain itu, kami juga akan menjelaskan faktor-faktor yang memengaruhi tekanan ini dalam sebuah larutan. Dengan pemahaman mendalam mengenai tekanan ini, kita dapat lebih memahami berbagai fenomena yang terjadi di dalam sel dan lingkungan sekitarnya. Mari kita simak penjelasan lengkapnya untuk mengungkap rahasia di balik peristiwa penting ini.
Apa itu tekanan osmotik?
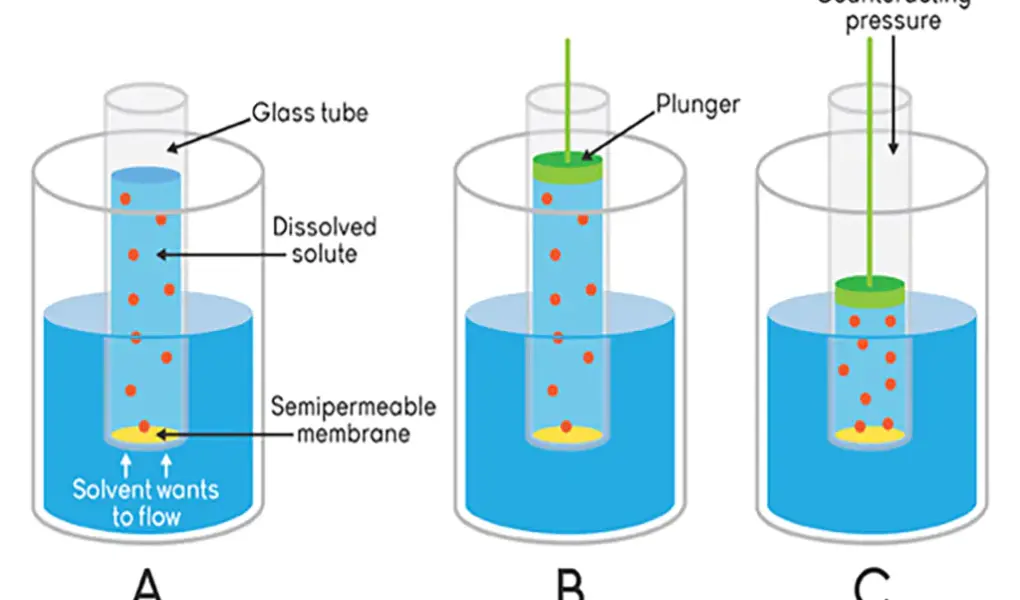
Tekanan osmotik adalah tekanan yang timbul ketika dua larutan dengan konsentrasi zat terlarut yang berbeda dipisahkan oleh membran semipermeabel. Ketika kedua larutan ini bersentuhan, molekul-molekul pelarut dari larutan dengan konsentrasi rendah akan berpindah melalui membran menuju larutan dengan konsentrasi tinggi hingga mencapai keseimbangan konsentrasi. Proses ini terjadi karena molekul-molekul pelarut bergerak secara acak, berupaya untuk menyamakan konsentrasi di kedua sisi membran.
Tekanan ini tergantung pada perbedaan konsentrasi zat terlarut antara kedua larutan. Semakin besar perbedaan konsentrasi, semakin tinggi tekanan yang dihasilkan. Tekanan ini juga memegang peranan penting dalam berbagai proses biologis, seperti penyerapan air oleh akar tanaman, regulasi tekanan darah dalam tubuh, serta transportasi nutrisi dan limbah di dalam sel-sel hidup.
Satuan osmotik umumnya diungkapkan dalam atmosfer (atm) atau pascal (Pa). Dalam dunia ilmu kimia dan biologi, konsep osmotik sangat penting untuk memahami berbagai proses yang terjadi di dalam sel dan lingkungan sekitarnya.
Contoh tekanan osmotik
Contoh-contoh tekanan ini dapat ditemukan dalam berbagai situasi di kehidupan sehari-hari. Berikut beberapa contoh:
- Penyerapan Air oleh Akar Tanaman: Ketika tanaman menyerap air melalui akarnya, terjadi perbedaan konsentrasi zat terlarut antara dalam sel akar dengan dalam tanah. Akibatnya, terjadi tekanan yang mendorong air masuk ke dalam sel akar hingga tanaman dapat mengambil nutrisi yang dibutuhkannya.
- Konsentrasi Sel Darah Merah dalam Tubuh: Sel darah merah dalam tubuh manusia mengandung konsentrasi garam dan zat terlarut lainnya yang lebih tinggi daripada plasma darah. Hal ini menyebabkan tekanan yang memungkinkan sel darah merah tetap mempertahankan bentuk dan volume yang tepat.
- Pengawetan Makanan: Proses pengawetan makanan dengan metode pengeringan atau pengasapan juga melibatkan tekanan osmotik. Konsentrasi garam yang tinggi pada makanan akan menarik air keluar dari mikroorganisme atau bakteri yang ada di dalamnya, menghambat pertumbuhan mikroorganisme tersebut, dan memperpanjang masa simpan makanan.
- Proses Dialisis dalam Pengobatan: Tekanan ini digunakan dalam proses dialisis untuk membersihkan darah penderita gagal ginjal. Cairan dialisis yang mengandung konsentrasi zat terlarut tertentu dipompa melalui membran semipermeabel untuk mengeluarkan limbah dan kelebihan zat terlarut dari darah.
Faktor yang Mempengaruhi
Terdapat beberapa faktor yang memengaruhi osmotik dalam suatu larutan. Beberapa faktor utama yang berperan adalah:
- Konsentrasi Zat Terlarut: Semakin tinggi konsentrasi zat terlarut dalam larutan, semakin tinggi pula tekanan yang dihasilkan. Artinya, semakin banyak zat terlarut yang ada dalam larutan, semakin besar perbedaan konsentrasi antara dua larutan yang dipisahkan oleh membran semipermeabel, dan hal ini akan menyebabkan tekanan yang lebih tinggi.
- Suhu: Suhu juga mempengaruhi osmotik. Pada suhu yang lebih tinggi, gerakan molekul-molekul dalam larutan menjadi lebih cepat, sehingga laju perpindahan molekul-molekul pelarut melalui membran semipermeabel juga meningkat. Akibatnya, tekanan dalam larutan akan meningkat seiring dengan peningkatan suhu.
- Jenis Zat Terlarut: Jenis zat terlarut yang berbeda juga dapat mempengaruhi tekanan osmotik. Beberapa zat terlarut mungkin memiliki efek osmotik yang lebih kuat daripada yang lain, tergantung pada ukuran molekulnya dan daya tarik antarmolekulnya.
- Ukuran Partikel Zat Terlarut: Ukuran partikel zat terlarut juga memainkan peran dalam tekanan osmotik. Partikel yang lebih besar cenderung lebih lambat bergerak melalui membran semipermeabel, sehingga dapat mengurangi tekanan secara keseluruhan.
- Jenis Membran Semipermeabel: Sifat dan struktur membran semipermeabel juga dapat mempengaruhi osmotik. Beberapa membran dapat lebih mudah dilewati oleh molekul-molekul pelarut, sehingga menghasilkan tekanan yang berbeda.
Rumus
Rumus tekanan ini dalam suatu larutan dapat dihitung dengan menggunakan persamaan berikut:
- π = M . R . T
- π = tekanan osmotik (atm)
- R = tetapan gas ideal (0,082 L atm mol/ K)
- M = konsentrasi larutan (mol/L)
- T = suhu (K)
Rumus tersebut menghubungkan tekanan osmotik (π) dengan konsentrasi larutan (M) dan suhu (T), serta melibatkan konstanta universal gas (R) sebagai faktor konversi untuk satuan konsentrasi dan suhu.
Contoh Soal
1. Sebuah larutan garam dapur (NaCl) memiliki konsentrasi sebesar 0,5 mol/L. Suhu larutan tersebut adalah 298 K. Hitunglah tekanan dari larutan tersebut menggunakan rumus π = M . R . T, dengan R = 0,082 L atm/mol K.
Penjelasan Penyelesaian: Dalam soal ini, kita diberikan nilai konsentrasi larutan (M = 0,5 mol/L) dan suhu larutan (T = 298 K).
π = M . R . T
Substitusi nilai yang diberikan:
π = 0,5 mol/L X 0,082 L atm/mol K X 298 K
Selanjutnya, lakukan perhitungan:
π = 0,5 mol/L X 24,436 L atm/mol
π ≈ 12,218 L atm
Jadi, tekanan dari larutan garam dapur (NaCl) dengan konsentrasi 0,5 mol/L pada suhu 298 K adalah sekitar 12,218 L atm.
2. Sebuah larutan glukosa (C6H12O6) memiliki konsentrasi sebesar 0,2 mol/L. Suhu larutan tersebut adalah 273 K. Hitunglah osmotik dari larutan tersebut menggunakan rumus π = M . R . T, dengan R = 0,082 L atm/mol K.
Penjelasan Penyelesaian: Dalam soal ini, kita diberikan nilai konsentrasi larutan (M = 0,2 mol/L) dan suhu larutan (T = 273 K).
π = M . R . T
Substitusi nilai yang diberikan:
π = 0,2 mol/L X 0,082 L atm/mol K X 273 K
Selanjutnya, lakukan perhitungan:
π = 0,2 mol/L X 22,446 L atm/mol
π ≈ 4,489 L atm
Jadi, tekanan dari larutan glukosa dengan konsentrasi 0,2 mol/L pada suhu 273 K adalah sekitar 4,489 L atm.
3. Sebuah larutan urea (CH4N2O) memiliki konsentrasi sebesar 0,1 mol/L. Suhu larutan tersebut adalah 25 °C. Hitunglah tekanan dari larutan tersebut menggunakan rumus π = M . R . T, dengan R = 0,082 L atm/mol K.
Penjelasan Penyelesaian: Dalam soal ini, kita diberikan nilai konsentrasi larutan (M = 0,1 mol/L) dan suhu larutan (T = 25 °C = 298 K).
π = M . R . T
Substitusi nilai yang diberikan:
π = 0,1 mol/L X 0,082 L atm/mol K X 298 K
Selanjutnya, lakukan perhitungan:
π = 0,1 mol/L X 24,436 L atm/mol
π ≈ 2,4436 L atm
Jadi, tekanan dari larutan urea dengan konsentrasi 0,1 mol/L pada suhu 25 °C (298 K) adalah sekitar 2,4436 L atm.
4. Sebuah larutan protein memiliki konsentrasi sebesar 0,5 mol/L. Suhu larutan tersebut adalah 37 °C. Hitunglah tekanan dari larutan tersebut menggunakan rumus π = M . R . T, dengan R = 0,082 L atm/mol K.
Penjelasan Penyelesaian: Dalam soal ini, kita diberikan nilai konsentrasi larutan protein (M = 0,5 mol/L) dan suhu larutan (T = 37 °C = 310 K).
π = M . R . T
Substitusi nilai yang diberikan:
π = 0,5 mol/L X 0,082 L atm/mol K X 310 K
Selanjutnya, lakukan perhitungan:
π = 0,5 mol/L X 25,42 L atm/mol
π ≈ 12,71 L atm
Jadi, tekanan dari larutan protein dengan konsentrasi 0,5 mol/L pada suhu 37 °C (310 K) adalah sekitar 12,71 L atm.
5. Sebuah larutan asam amino kompleks memiliki konsentrasi sebesar 0,02 mol/L dan mengandung tiga jenis asam amino yang berbeda dengan konsentrasi masing-masing sebagai berikut: asam amino A (C5H9NO2) dengan konsentrasi 0,008 mol/L, asam amino B (C6H13NO2) dengan konsentrasi 0,006 mol/L, dan asam amino C (C4H7NO4) dengan konsentrasi 0,006 mol/L. Suhu larutan tersebut adalah 25 °C. Hitunglah tekanan dari larutan ini menggunakan rumus π = M . R . T, dengan R = 0,082 L atm/mol K.
Penjelasan Penyelesaian: Dalam soal ini, kita diberikan nilai konsentrasi larutan kompleks (M = 0,02 mol/L), konsentrasi masing-masing asam amino A (0,008 mol/L), asam amino B (0,006 mol/L), dan asam amino C (0,006 mol/L), serta suhu larutan (T = 25 °C = 298 K).
π = M . R . T
Tetapi sebelum menghitung tekanan osmotiknya, kita perlu menghitung konsentrasi total larutan yang merupakan jumlah konsentrasi dari masing-masing komponen:
Konsentrasi Total = Konsentrasi A + Konsentrasi B + Konsentrasi C Konsentrasi Total = 0,008 mol/L + 0,006 mol/L + 0,006 mol/L Konsentrasi Total = 0,02 mol/L
Setelah mendapatkan nilai konsentrasi total, kita substitusi nilai tersebut ke dalam rumus:
π = 0,02 mol/L X 0,082 L atm/mol K X 298 K
Selanjutnya, lakukan perhitungan:
π = 0,02 mol/L X 24,436 L atm/mol
π ≈ 0,48872 L atm
Jadi, tekanan dari larutan asam amino kompleks dengan konsentrasi masing-masing asam amino yang berbeda pada suhu 25 °C (298 K) adalah sekitar 0,48872 L atm.
Demikianlah ulasan mengenai tekanan osmotik. Dengan memahami osmotik dan berbagai faktor yang mempengaruhinya, kita dapat lebih menghargai kompleksitas dan pentingnya fenomena ini dalam berbagai aspek kehidupan.